Demo-Experimente
Volumenanstieg durch die Bildung von Gasen
Werden bei Reaktionen unerwartet große Mengen an Gasen oder Dämpfen frei, kann dies zu einer Drucksteigerung führen, der die Apparatur nicht standhalten kann. Im Modellversuch werden hier gleichzeitig zu einer kleinen Menge Spülmittel Wasserstoffperoxidlösung und Kaliumiodidlösung, die den Zerfall des H2O2 katalysiert, gegossen. Der sofort entstehende Schaumpilz zeigt anschaulich die Volumenvergrößerung durch den abgespaltenen Sauerstoff an.
Hier können Sie den Videoclip herunterladen:
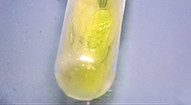
Durchbruchsverhalten von Handschuhmaterial
Man fühlt sich geschützt, wenn man seine persönliche Schutzausrüstung angelegt hat. Dies ist auch gegeben, wenn die PSA richtig und der Aufgabenstellung angemessen ausgewählt wurde und korrekt benutzt wird. Andernfalls kann es sich stattdessen um eine gefährliche Scheinsicherheit handeln, die die Gesundheit oder sogar das Leben kosten kann.
Die Auswahl der richtigen Handschuhe benötigt Sachverstand. Der Griff zum immer gleichen Handschuh, nur weil dieser schon immer benutzt wurde und – vielleicht sogar als einziger – zur Verfügung steht, kann gefährlich sein.
Im Versuch wird ein abgeschnittener Finger eines Nitril-Einmalhandschuhs in alkalische Kaliumtriiodidlösung getaucht, 1 ml Aceton hinein pipettiert und der Finger oben verschlossen. Innerhalb einiger Sekunden beginnt an der Handschuhoberfläche die Bildung gelber Schlieren eines Niederschlags von Triiodmethan (Iodoformprobe), die anzeigen, das Aceton durch das Handschuhmaterial hindurchtritt.
Damit ist gezeigt, wie rasch ein solches, keineswegs ungewöhnliches Lösemittel wie Aceton (und etliche andere) durch das falsch ausgewählte Handschuhmaterial hindurchdringen können und dabei gelöste Stoffe zur Haut hindurch mit transportieren. Am Beispiel Aceton lässt sich auch ein weiteres Problem erkennen: es gibt kaum ein Handschuhmaterial, das gegen das Durchdringen von Aceton längere Zeit resistent wäre.
Hier können Sie den Videoclip herunterladen:
Chemische Zerstörung von Handschuhen
In einen abgeschnittenen Finger eines Nitril-Einmalhandschuhs wird wasserfreie Salpetersäure gegeben. Der Handschuh entzündet sich durch die hohe Oxidationskraft der Salpetersäure spontan. Hier ist gar kein Handschuh zu finden, mit dem sicher gearbeitet werden könnte. Dagegen hilft es, das Arbeitsverfahren so zu gestalten, dass der Kontakt mit der Hand vermieden wird, im gezeigten Versuch durch Verwenden einer ausreichend langen Stativklammer.
Hier können Sie den Videoclip herunterladen:
Absorption und Desorption von Gasen von Atemschutzfiltern
Getrocknete Aktivkohle wird über eine Einwurfeinrichtung in den mit Chlorgas gefüllten Rundkolben einer geschlossenen Apparatur gegeben. Zum besseren Kontakt zwischen der festen Oberfläche der Aktivkohle und der Gasphase wird die Aktivkohle dabei mit einem Magnetrührstäbchen gerührt. Der Kolben ist mit einem zweiten, luftgefüllten Kolben auf der rechten Seite über einen Teflonschlauch verbunden, der wiederum mit einer Tauchung mit blau gefärbtem Wasser in dem Erlenmeyerkolben in der Mitte verbunden ist. Man sieht, dass das blaue Wasser in den luftgefüllten Kolben zurückgedrückt wird, weil im ersten Kolben der Gasdruck absinkt, da das Chlor rasch an der Aktivkohle adsorbiert wird.
Nachdem die Aktivkohle mit Chlor gesättigt ist, lässt sich dieses durch Erhitzen mit einem Heißluftfön wieder desorbieren. Dadurch wird das blau gefärbte Wasser (der Farbstoff wird durch das Chlor angegriffen und verblasst langsam) wieder in den rechten Rundkolben zurückgedrückt.
Anschließend wird Chlor über eine zweite Füllung der getrockneten Aktivkohle unter Rühren geleitet (der Überschuss wird in dem Absorptionsturm ganz rechts zurückgehalten), bis die Aktivkohle mit Chlor gesättigt ist. Diese Kohle wird nun in einem Rundkolben im Vakuum ausgeheizt und das desorbierte Chlorgas in einer stickstoffgekühlten Falle ausgefroren. Man erkennt in der auftauenden Falle das geschmolzene und bereits siedende Chlor, das von der Aktivkohle aufgenommen worden war.
In einem weiteren Versuch wird die Aktivkohle längere Zeit Wasserdampf ausgesetzt. Wird nun Chlor darauf einwirken lassen und anschließend durch Ausheizen in die gekühlte Falle transportiert, so wird darin fast nur Wasser gefunden, die feuchte Aktivkohle war nicht in der Lage, das Chlor aufzunehmen.
Atemschutzfilter haben eine begrenzte Kapazität zur Aufnahme gefährlicher Gase und Dämpfe, ein Überschuss dringt durch den Filter hindurch. Nur ordnungsgemäß gelagerte Atemschutzfilter bieten ausreichenden Schutz.
Hier können Sie den Videoclip herunterladen:
Versuch zur Schutzfunktion eines Labormantels
Auf drei Uhrgläser werden Würfelzuckerstücke gegeben. Auf zwei davon wird je ein Stück Textil von einem Labormantel und gewöhnlichem Kleidungsstoff gelegt. Auf alle drei Proben wird etwas konzentrierte Schwefelsäure getropft. Diese zersetzt den Zucker unter exothermer Bildung von Schwefelsäure-Hydraten rasch unter Abspaltung von Wasser zu schwarzen, kohligen Reaktionsprodukten.
Der Kleidungsstoff weist nach kurzer Zeit ein Loch auf, das die Säure hineingefressen hat, der Zucker darunter wird ebenfalls angegriffen. Das Stück vom Labormantel widersteht der Säure deutlich länger, es tritt eine kleine Menge Schwefelsäure hindurch und führt zu Verfärbungen am Zucker. Damit ist die Schutzfunktion eines Labormantels deutlich zu erkennen, er erfüllt eine mitunter erstaunlich wirksame Barrierefunktion gegen Kontaminationen.
Hier können Sie den Videoclip herunterladen:
Versuch zur Brennbarkeit von Handschuhmaterial
Auf je einen Nitril-Einmalhandschuh und einen Viton-Handschuh werden ca. 2 ml tert.-Butyllithiumlösung (1,9 m in Pentan) gespritzt. Die pyrophore Flüssigkeit entzündet sich spontan und verbrennt den Nitrilhandschuh innerhalb weniger Sekunden zu etwas trockener Asche. Der Viton-Handschuh entzündet sich nicht, zersetzt sich aber in der Flamme und reißt auf. Es muss also bei der Gefährdungsbeurteilung sorgfältig untersucht werden, ob die Gefährdung der Hände durch Kontakt mit der pyrophoren Flüssigkeit größer ist, als wenn ein brennender Handschuh nur schwer von der Hand zu entfernen ist. Ein wichtiger Faktor ist die sichere Ausführung der Handgriffe bei dem verwendeten Arbeitsverfahren, damit nicht durch Ungeschicklichkeiten, die aus der reduzierten Taktilität beim Tragen gerade dickerer Handschuhe resultieren, zusätzliche Gefährdungen entstehen.
Hier können Sie den Videoclip herunterladen:
Zerstörung von Glas durch Flusssäure
Sind Materialien nicht beständig gegen die chemischen und physikalischen Einwirkungen, kommt es zum Versagen der Apparaturen und Anlagen mit teilweise ganz erheblichen Folgen.
Im Versuch wird in ein dünnwandiges Glaskölbchen aus Borosilikatglas 3.3, dem gängigen Glas für Laborgeräte und Glasapparate, eine kleine Menge 40prozentige Flusssäure gegeben. Die Kolbenwandung wird innerhalb weniger Minuten komplett zerstört und die Flusssäure tritt aus.
Hier können Sie den Videoclip herunterladen:
Reaktion von Iod mit Chlor
Oxidationsprozesse verlaufen häufig mit großer Wärmeentwicklung. Dabei verbrennen Stoffe nicht nur mit Sauerstoff, meist aus der Luft, sondern solche Oxidationsprozesse geschehen auch zwischen Stoffen, von denen man dies vielleicht nicht erwartet. Im Experiment wirkt Chlor als Oxidationsmittel auf elementares Iod ein. Das Iod wird spontan zum Monochlorid und im Überschuss von Chlor auch teilweise zum Iodtrichlorid oxidiert. Das Iodmonochlorid bildet beim Auftreffen des Chlors in dem Reaktionsgefäß sofort rotbraune Dämpfe, die zu einer Flüssigkeit kondensieren.
Wenn auch die meisten Verbrennungsreaktionen, die zu Havarien und Unfällen führen, durch Verbrennung mit Luftsauerstoff hervorgerufen werden, müssen bei einer Gefährdungsbeurteilung auch entsprechende andere Reaktionen berücksichtigt werden.
Hier können Sie den Videoclip herunterladen:
Reaktion von Chlor mit Kupfer und mit Eisen
Chlor ist ein starkes Oxidationsmittel, in dem viele Stoffe so heftig brennen, wie in Sauerstoff. Die beiden Experimente zeigen, wie heftig Kupfer (hier in Form von Drähten) und Eisen (in Form von Stahlwolle) reagieren, wenn ein Chlorgasstrom auf diese trifft. Der entstehende Rauch besteht aus den wasserfreien Chloriden der Metalle.
Hier können Sie den Videoclip herunterladen:
Reaktion von Aluminium mit Iod
Viele Stoffe reagieren erst unter bestimmten Bedingungen wie Temperatur oder Druck. Tückisch sind solche Vorgänge, wenn diese zeitverzögert und zudem noch bei Kontakt mit einem Lösch- oder Reinigungsmittel auftreten. Im Experiment wird ein Gemisch von Aluminium und Iod mit etwas Wasser angefeuchtet, wie man es zum Binden von Staub beim Entfernen von Staubablagerungen häufig tut. In diesem Fall führt dieses gut gemeinte Vorgehen zur Staubbindung allerdings zu einer heftigen Reaktion, bei der unter enormer Hitzeentwicklung große Mengen an violettem Dampf des ätzenden Iods ausgestoßen werden.
Ist der Rückstand dann abgekühlt und soll entsorgt werden und würde dazu nun mit Wasser angefeuchtet, käme es unter Erhitzung zur Bildung von ätzendem Iodwasserstoff aus dem gebildeten wasserfreien Aluminium(III)-iodid. Die Hinweise zu gefährlichen Reaktionen im Sicherheitsdatenblatt müssen daher auch für die Reinigung und Entsorgung beachtet werden.
Reaktion von Kalium mit Wasser
Die Metalle der ersten Hauptgruppe des Periodensystems der Elemente sind sehr reaktionsfreudige Stoffe. Sie besitzen eine mit der Ordnungszahl ansteigende Reaktivität, vom Lithium über das Natrium und das Kalium bis zum Rubidium und zum Caesium. Während die ersten drei Stoffe unter einer Schutzflüssigkeit (Mineralöl) zum Schutz vor der Luft aufbewahrt werden können (allerdings altern auch diese verschieden rasch zu gefährlichen Reaktionsprodukten, siehe dazu auch den Beitrag „Gefahren durch Alkalimetallbestände“ im Fachwissen-Portal und T. H. Brock, A. Ahrens-Moritz, D. Reichard: Nachrichten aus Chemie, Technik und Laboratorium 46 (1998) 16), werden Rubidium und Caesium unter Schutzgas in abgeschmolzenen Ampullen aufbewahrt.
Im Versuch wird eine kleine Menge Kalium vom anhaftenden Öl und von Krusten befreit (zum Problem der Krusten siehe die Verweise oben) in ein Becherglas mit Wasser und mit Phenolphthalein als Indikator gegeben. Das Kalium reagiert spontan unter Wasserstoffbildung, dieser entzündet sich sofort. Nach kurzer Zeit zerplatzt die geschmolzene Kaliumkugel, da sich auf dieser eine immer größer werdende positive Ladung ansammelt, die die Kugel anschließend durch die elektrostatischen Abstoßungskräfte zwischen den positiven Ladungen zerreißt. Glühende Kalium- und Kaliumhydroxidpartikel werden umhergeschleudert, dazu die heiße gebildete Kalilauge. Wird das Kaliumstück nur ein wenig zu groß gewählt, kommt es zu einer kaum beherrschbaren, heftigen Explosion.
Am Ende des Videos werden die Metalle Kalium, Rubidium, Lithium und Natrium (von oben links im Uhrzeigersinn) beim Kontakt mit dem Wasser in der Momentaufnahme gezeigt.
Der Versuch zeigt das hohe Reaktionsvermögen mancher Stoffe, zudem auch die Inkompatibilität des sonst bewährten Löschmittels Wasser mit dazu unverträglichen Stoffen.
Hier können Sie den Videoclip herunterladen:
Magnesium brennt in Kohlendioxid
Kohlendioxid ist ein weit verbreitetes Löschmittel („Kohlensäurelöscher“) und für viele Brände gut verwendbar. Jedoch kann es auch zwischen brennenden Stoffen und dem Löschmittel zu Reaktionen kommen, die eine zusätzliche Gefährdung hervorrufen.
Im Experiment werden Magnesiumspäne (für Grignard-Reaktionen) in einem Block Trockeneis (handelsübliches festes Kohlendioxid mit einer Temperatur von –78 °C) entzündet und es wird versucht, durch Abdecken mit einem zweiten Block Trockeneis zu löschen. Anstelle des Verlöschens des Brandes in dem kalten Löschmittel wird der Brand sogar angefacht. Magnesium entreißt dem Kohlendioxidmolekül den Sauerstoff und verbrennt unter großer Hitzeentwicklung zu Magnesiumoxid (daher auch die grelle weiße Glut). Nach der Reaktion findet man ein Gemisch aus weißem Magnesiumoxid und schwarzem Kohlenstoff aus dem Kohlendioxid.
Es muss also immer bei der Planung von Maßnahmen bei Bränden (und anderen Havarien) daran gedacht werden, ob es zu gefährlichen Reaktionen kommen kann.
Hier können Sie den Videoclip herunterladen:
Die englischsprachige Version erreichen Sie durch Klick auf das Flaggen-Symbol.